Contrariamente alle direttive, che devono essere recepite nel diritto nazionale, i regolamenti hanno portata generale, sono obbligatori in tutti i loro elementi e direttamente applicabili negli ordinamenti degli Stati membri.
L’utilizzatore finale deve controllare che i dispositivi in uso al suo studio siano in compliance con i nuovi requisiti del regolamento, In pratica deve controllare:
1) l’esistenza della identificazione e tracciabilità del dispositivo prevista

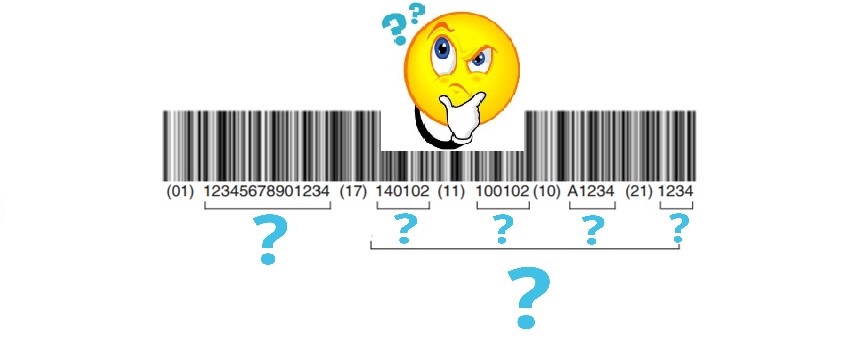
I dispositivi medici devono obbligatoriamente riportare nella confezione i seguenti dati:
Etichette e istruzioni per l’uso Ogni dispositivo deve essere corredato delle informazioni necessarie a identificare il dispositivo e il fabbricante e da tutte le informazioni in materia di sicurezza e prestazione pertinenti per gli utilizzatori o per altre persone, a seconda dei casi.
Tali informazioni possono figurare sul dispositivo stesso, sul confezionamento e nelle istruzioni per l’uso e, se il fabbricante dispone di un sito web, sono messe a disposizione e aggiornate sul sito web, tenendo conto che il supporto, il formato, il contenuto, e la collocazione debbano essere adeguati alla sua destinazione d’uso e al livello di competenza dell’utilizzatore previsto
2) che il dispositivo sia in confezionamento originale
devono essere confezionati da parte del produttore e non confezionati e poi riconfezionati da parte del proprietario del dispositivo
3) deve farsi carico della segnalazione di incidenti
la segnalazione di incidenti che avvengono durante l’uso di dispositivi medici deve essere trasmessa al Ministero della salute.
A seguito di queste segnalazioni, soprattutto in caso di ripetuti incidenti avvenuti durante l’utilizzo dello stesso dispositivo medico,
il Ministero della salute può avviare un esame più approfondito anche su altri aspetti del dispositivo coinvolto,
richiedendo chiarimenti al fabbricante sulle varie fasi della marcatura CE e procedendo alla valutazione delle criticità emerse.
4) deve conservare tutta la documentazione idonea ad assicurare la sorveglianza
La sorveglianza del mercato dei dispositivi medici Il Ministero della salute ed il Ministero dello sviluppo economico sono le Autorità Competenti per i dispositivi medici e vigilano sull’applicazione della normativa nazionale (D. Lgs. 46/97 e D. Lgs. 507/92) attuando un programma di controlli sulle diverse componenti della catena di commercializzazione dei dispositivi medici (fabbricanti, distributori ed utilizzatori). Tale attività (Market Surveillance), in assenza di un sistema di autorizzazioni preventive da parte dell’Amministrazione pubblica, costituisce un pilastro fondamentale del sistema di marcatura CE dei dispositivi medici e si concretizza, per quanto riguarda il Ministero della salute, con varie modalità finalizzate a verificare l’operato dei fabbricanti, dei distributori, dei commercianti, degli importatori a garanzia della salute pubblica e degli utilizzatori finali.
Come adeguarsi al regolamento senza incorrere in sanzioni e maggiori oneri?
i dispositivi medici non conformi al nuovo regolamento non vanno più utilizzati e sostituiti con dispositivi conformi meglio se a noleggio così da avere la certezza di non dover ricomprare i dispostivi alla scadenza ed aver e un fornitore che ci pensa lui alle scadenze e alle sostituzioni.
Perché sceglierci ?
E’ nel nostro DNA proporvi una soluzione pratica ed economica in ambito dell’emergenza ed utilizzo dei gas, ci adoperiamo al meglio per fornirvi una soluzione adatta alle vostre esigenze, troverà interlocutori sempre attenti alle sue esigenze ed al rispetto della norma cosi da poterle fornire un prodotto utile per il lavoro, sicuro nell’utilizzo e a norma evitando cosi sanzioni ed problemi da gestire e risolvere.
https://sbgas.net/prodotto/set-dispositivi-medici/
scarica il Regolamento UE 2017/745: